

體外診斷試劑作為疾病篩查、診斷和治療監測的重要工具,其生產質量直接關系到臨床檢測的準確性和患者安全。近年來,隨著國家藥監局《醫療器械生產質量管理規范附錄體外診斷試劑》等法規的持續更新,以及行業對產品溯源性和穩定性的高標準要求,建設符合GMP標準的潔凈車間已成為體外診斷企業的剛需。體外診斷試劑到中試及生產環節,就需要在GMP潔凈廠房的條件下進行。體外診斷試劑應符合《體外診斷試劑生產實施細則(試行)》的要求...
體外診斷試劑作為疾病篩查、診斷和治療監測的重要工具,其生產質量直接關系到臨床檢測的準確性和患者安全。近年來,隨著國家藥監局《醫療器械生產質量管理規范附錄體外診斷試劑》等法規的持續更新,以及行業對產品溯源性和穩定性的高標準要求,建設符合GMP標準的潔凈車間已成為體外診斷企業的剛需。體外診斷試劑到中試及生產環節,就需要在GMP潔凈廠房的條件下進行。體外診斷試劑應符合《體外診斷試劑生產實施細則(試行)》的要求。平面布局要求合理緊湊,人流、物流路線清晰明了;參觀、消防通道暢通。每個凈化級別符合生產需求;潔凈區、人員凈化、物料凈化和其他輔助用房分區布置,同時考慮生產操作、工藝設備安裝和維修、管線布置、氣流以及凈化空調系統各種技術設施的綜合協調;不同空氣潔凈度等級房間之間聯系頻繁時,設有防止污染的措施,如緩沖間、氣閘室、傳遞窗等。
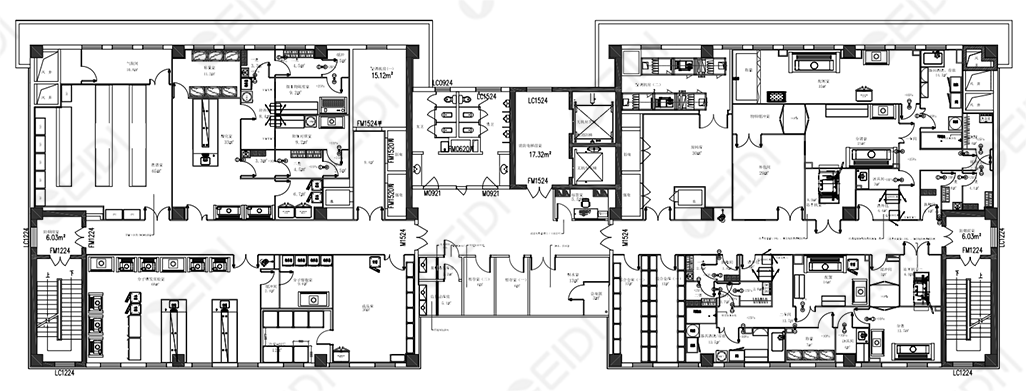
CEIDI西遞設計組會與使用方技術負責人明確生產工段所處的環境要求,對有空氣凈化級別的工序進行凈化設計,背景凈化環境按照以下要求設置:
1.普通化學類診斷試劑的生產可以在清潔環境中進行。
2.陰性、陽性血清、質粒或血液制品的處理操作可以設計C級環境,與相鄰區域保持相對負壓,并符合防護規定。
3.酶聯免疫吸附試驗試劑、免疫熒光試劑、免疫發光試劑、聚合酶鏈反應(PCR)試劑、金標試劑、干化學法試劑、細胞培養基、校準品與質控品、酶類、抗原、抗體和其他活性類組分的配制及分裝等產品的配液、包被、分裝、點膜、干燥、切割、貼膜,以及內包裝等工藝環節,至少控制于D級凈化環境 。
4.無菌物料的分裝工藝段環境設計為局部B級。

在實際項目推進中,環境建設的達成是由多個技術系統共同組成,其中包括但不限定于裝飾部分的圍合施工、空調及排風系統的凈化配置、壓差系統的控制等等。每個項目的具體使用端要求的不同,就如航行的大船需要舵手一般,需要有經驗的和資質的設計單位與施工單位合作進行。當然如果將設計、施工甚至采購都能三位一體的統籌總包,之于精準醫療行業這類對環境有專業要求的場所來說,是較為理想的建設模式。
只需使用方給出明確的具有污染性、傳染性和高生物活性的物料,明確生產過程中會有哪些風險,CEIDI西遞設計組就可以此為依據制定合適的技術方案及空間環境受控方式,有效避免造成傳染、污染或泄漏等。幾個特殊的類別需要特別建設受控環境,列舉如下:
1.高風險的生物活性物料的操作我們會設計分割單獨用室,且使用單獨的空氣凈化系統,與相鄰區域保持負壓,排出的空氣不進循環系統,通過專業凈化處理后按指定路徑排出。
2.進行危險度二級及以上的病原體操作用室,CEIDI西遞會予以配置恰當的生物安全柜,將空氣進行有效處理后排出。
3.特殊的高致病性病原體的采集、制備,根據標準規范按照衛生部頒布的行業標準《微生物和生物醫學實驗室生物安全通用準則》等相關規定,裝備全套P3級實驗室相應設施。
4. 激素類試劑組分的潔凈室(區)我們推薦采用獨立的專用的空氣凈化系統,排出的空氣不進循環系統,通過專業凈化處理后按指定路徑排出。
5. 強毒微生物操作區、芽孢菌制品操作區應與相鄰區域保持相對負壓,配備獨立的空氣凈化系統。
6.生產聚合酶鏈反應(PCR)試劑的,其生產和檢驗應當在獨立的建筑物或空間內進行,受控環境建設要保證空氣不直接聯通,防止擴增時形成的氣溶膠造成交叉污染。

當然,也有體外診斷試劑品類對生產環境沒有空氣凈化要求的,環境設置為清潔環境即可,在此環境內完成工藝流程。除了以上幾個核心受控環境需要做全方位的技術方案外,還要重視原料或者參考品、物料的存儲環境。譬如具有傳染性或來源于生物體的物料如含陽性病原體的參考品、動物腹水或血清、人體樣品(體液、血液等)等物料,要按照 中華人民共和國國務院令第424號《病原微生物實驗室生物安全管理條例》,衛生部《人間傳染的病原微生物名錄》等要求,設計符合具體產品儲存要求和防護要求的空間環境。CEIDI西遞在醫學診斷實驗及潔凈車間工程案例較多,有需要的企業可以聯系我們獲取詳細方案及報價。


相關閱讀: